Das 1x1 des Product Lifecycle Reportings unter der MDR – So bleiben Sie immer auf Kurs!
Die Anforderungen der MDR an die Dokumentation von Medizinprodukten sind komplex. Doch mit der richtigen Strategie ist es kein Hexenwerk, alle Phasen - von der klinischen Bewertung bis zum Post-Market Surveillance - effizient umzusetzen.
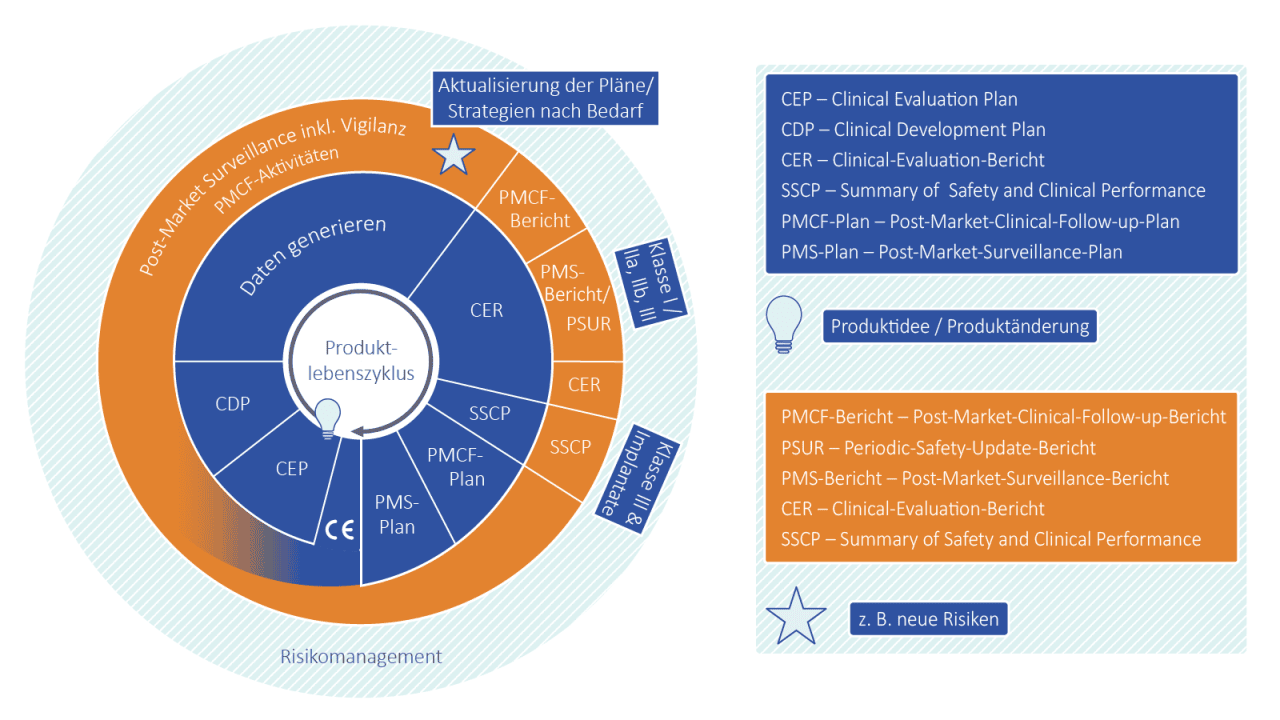
Ein zentraler Erfolgsfaktor bei der Umsetzung der MDR ist eine gut abgestimmte Strategie für das Product Lifecycle Reporting. Diese Strategie sollte sicherstellen, dass alle relevanten Prozesse effizient miteinander verknüpft sind, von der klinischen Bewertung bis zum Post-Market Surveillance (PMS)-System. Nur durch eine enge Verzahnung der verschiedenen Phasen können Risiken rechtzeitig erkannt und entsprechende Maßnahmen ergriffen werden.
Die Herausforderung liegt darin, dass die Anforderungen nicht nur während der Entwicklung und Markteinführung gelten, sondern auch während des gesamten Lebenszyklus eines Produkts kontinuierlich angepasst und aktualisiert werden müssen. Eine vorausschauende Planung und regelmäßige Aktualisierung der Berichte sind dabei entscheidend, um den Anforderungen jederzeit gerecht zu werden und flexibel auf Veränderungen zu reagieren.
Mit einer klaren Strategie und einem gut strukturierten Prozess können Hersteller alle MDR-Anforderungen effizient erfüllen und sicherstellen, dass ihre Produkte auch nach der Markteinführung sicher und leistungsfähig bleiben.
Möchten Sie erfahren, wie Sie Ihr Product Lifecycle Reporting unter der MDR optimal managen? Unser Blogbeitrag erklärt das Vorgehen Schritt für Schritt.
Beitrag von

Metecon GmbH
Mannheim, DeutschlandIhre Kontaktperson